Общая информация. Тошнота и рвота во время беременности чаще всего возникают в первом триместре. Если не лечить, развитие гиперемезиса беременных может привести к дальнейшим осложнениям, характеризующимся обезвоживанием и электролитными нарушениями.
1 Ондансетрон, антагонист рецепторов 5-HT3, быстро стал наиболее часто назначаемым лекарством в США для тошнота и рвота во время беременности.
2 С созданием растворяющих таблеток в 2006 году популярность Ондансетрона как противорвотного средства продолжает расти. Фактически, исследование, проведенное в 2014 году, показывает, что почти четверть всех беременных женщин в Соединенных Штатах используют его.
3 В литературе нет сомнений в связи между ондансетроном и врожденными дефектами. В то время как некоторые исследования сообщают, что у женщин, принимавших это противорвотное средство на ранних сроках беременности, нет повышенного риска врожденных аномалий, другие данные свидетельствуют о том, что это может быть связано с волчьей пастью и пороками сердца. 2 Авторы этого исследования стремились найти изучить связь между воздействием ондансетрона в первом триместре беременности и риском врожденных пороков развития новорожденных с использованием национальной когорты беременных женщин, застрахованных государством.
Клинический вопрос: Связано ли воздействие ондансетрона в первом триместре беременности с повышенным риском врожденных пороков развития у новорожденных (с акцентом на пороки развития сердца и расщелины ротовой полости)?
Что они сделали:
- Ретроспективное когортное исследование, в котором изучается около 1,8 миллиона беременностей из общенационального агентства Medicaid Analytic eXtract (MAX), которое ранее использовалось для изучения безопасности лекарств во время беременности.
- Женщины считались подвергшимися воздействию , если они получали хотя бы один рецепт ондансетрона в течение первых 3 месяцев беременности (период органогенеза).
- Женщины считались «не подвергавшимися воздействию», если они не получали хотя бы один рецепт на ондансетрон в течение первых 3 месяцев беременности.
- Женщины, выписавшие рецепт на пиридоксин (с доксиламином или без него), прометазин, метоклопрамид или любой из этих альтернативных методов лечения в течение первых 90 дней беременности, использовались в качестве альтернативной контрольной группы.
- Наличие врожденных пороков развития определялось с помощью алгоритма, основанного на стационарных или амбулаторных диагнозах и кодах процедур в истории болезни матери или плода.
- Авторы также рассмотрели потенциальные факторы, вызывающие искажение, и / или их заместители.
Авторы использовали показатели склонности для корректировки большого количества ковариат, и были проведены следующие анализы:
- Первичный скорректированный анализ = Для учета возможного смешивающего эффекта показания для лечения и связанных с ним факторов.
- Вторичный скорректированный анализ = Для учета всех потенциальных мешающих переменных. Эти результаты были интерпретированы как предварительные.
- Подтверждающий анализ = Высокомерный анализ предрасположенности включал 200 эмпирически определенных ковариат в дополнение к заранее заданным ковариатам.
- Анализ чувствительности = Проводится для проверки надежности первичных результатов.
- Две группы (экспонированная и необлученная) оценивались с использованием стандартизованных различий. Абсолютная стандартизованная разница более 0,1 считалась показателем существенного дисбаланса между двумя группами воздействия.
- Абсолютные нескорректированные относительные риски и различия рисков с их 95% доверительными интервалами были рассчитаны для каждого результата.
Критерии включения:
- Женщины в возрасте от 12 до 55 лет.
- Покрытие Medicaid от 3 месяцев до даты последней менструации до 1 месяца после родов.
- Вы получили хотя бы один рецепт на ондансетрон в течение первых трех месяцев беременности.
- Младенцы с покрытием Medicaid в течение первых трех месяцев жизни, если они не умерли раньше.
Критерии исключения:
- Беременность с воздействием других известных тератогенов (например, варфарина, противоопухолевых препаратов, лития, изотретиноина, мизопростола, талидомида и т. д.).
- Беременность с хромосомной аномалией.
- Женщины, которые получали ондансетрон за 3 месяца до беременности.
- Пороки развития сердца диагностированы в течение 1 st 90 дней после родов.
- Пороки развития расщелины полости рта диагностированы в течение 1 st 90 дней после родов.
- Врожденные пороки развития в целом.
- Определенные подгруппы пороков развития сердца (например, дефекты конотрункала, дефекты единственного желудочка, дефекты межжелудочковой перегородки и т. д.).
- Определенные подгруппы пороков развития расщелины ротовой полости (например, волчья пасть, расщелина губы, расщелина губы и неба).
- Были оценены риски других специфических пороков развития (глаз, ушей, ЦНС, органов дыхания, желудочно-кишечного тракта, мочевыводящих путей, половых органов и т. д.).
Что они изменили:
- В ходе своего анализа авторы изменили контрольную группу на женщин, которые выполнили рецепт на другое противорвотное средство в течение первого триместра, чтобы они были более сопоставимы с женщинами, получавшими ондансетрон, чем с женщинами, которые никогда не получали противорвотные средства во время беременности.
- Экспозиция была переопределена как получение 2 или более рецептов на ондансетрон в течение первого триместра, а интервал воздействия определен как от 6 до 12 недель после даты последней менструации.
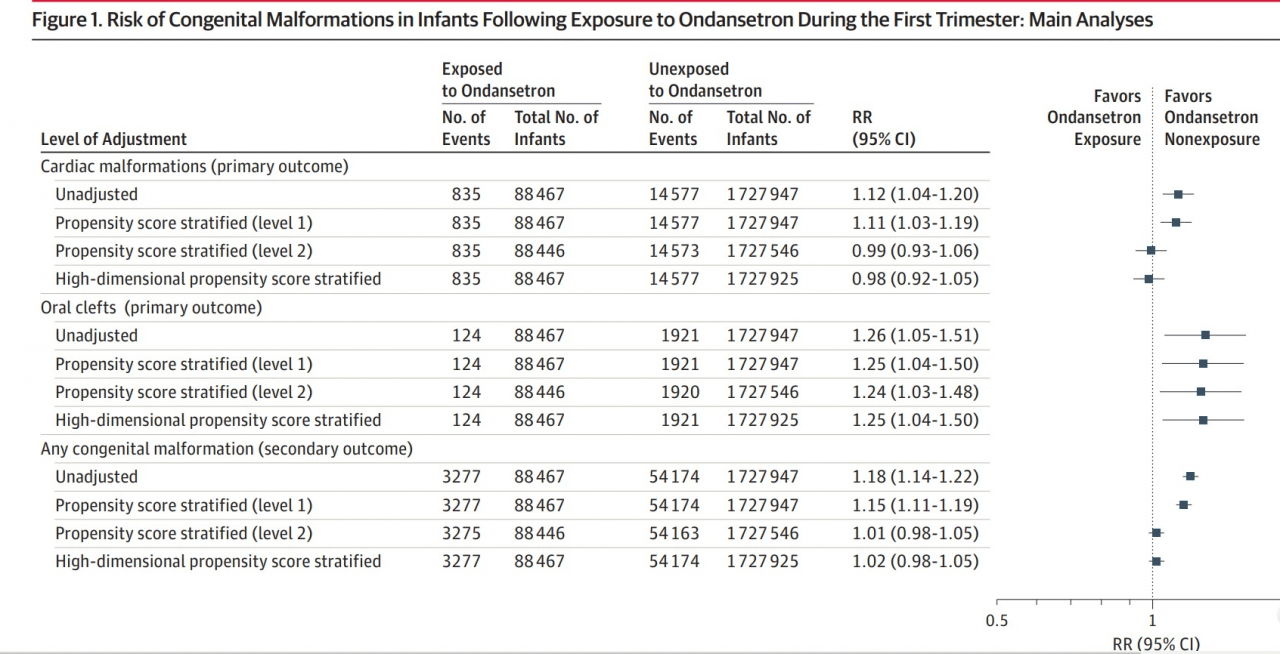
- Из 1 816 144 беременностей 88 467 (4,9%) подверглись воздействию ондансетрона, а 1 727 947 не подверглись воздействию.
Всего 1 502 895 женщин внесли в когорту следующее:
- 1 беременность: 1 251 216 (83,3%).
- 2 беременности: 203 037 (13,5%).
- 3 и более беременностей: 48, 642 (3,2%).
Критические результаты:
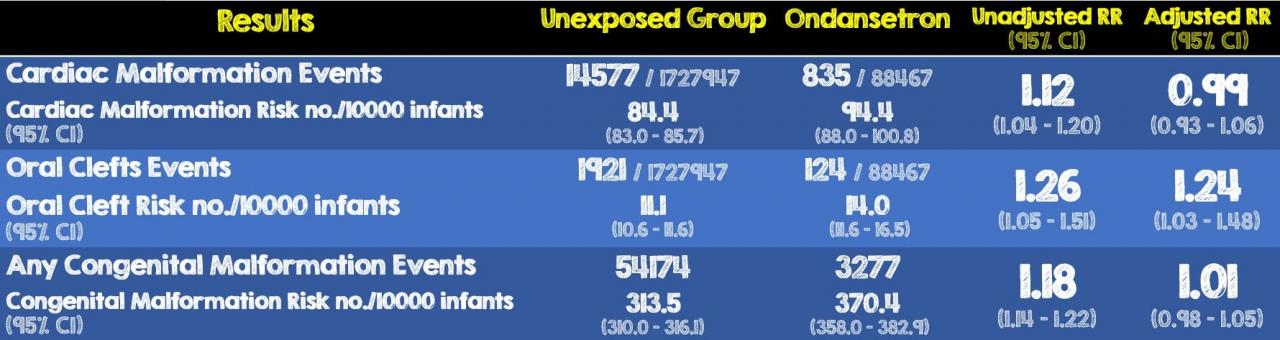
- Было отмечено небольшое увеличение риска развития расщелины ротовой полости, связанного с воздействием ондансетрона. Верхний предел относительного риска с поправкой на 95% ДИ составил 1,48, что соответствует 5 дополнительным случаям на 10 000 рождений, подвергшихся пренатальному облучению.
- Результаты при использовании женщин, принимавших другие противорвотные средства в качестве контрольной группы, соответствовали результатам основного анализа (скорректированный RR для пороков сердца, 1,01; 95% ДИ, 0,92-1,12; для ротовой щели, скорректированный RR, 1,32; 95% ДИ. 1,03–1,70; ОР любого врожденного порока 1,00; 95% ДИ 0,95–1,05.
- Результаты, как правило, не зависели от изменений в определении воздействия (≥2 назначения, 6–12 недель).
- В отличие от предыдущих исследований, в которых оценка воздействия была основана на самоотчетах женщин, использование медицинских записей из крупной известной базы данных устраняет предвзятость самоотчетов, которая может возникнуть, когда женщины рожают ребенка с врожденным пороком развития.
- Использование базы данных MAX и, в частности, предполагаемый сбор информации о заполненных лекарствах устраняет потенциальную ошибку отзыва.
- Для проверки надежности первичных результатов использовался анализ чувствительности.
- Авторы количественно оценили возможность систематической ошибки отбора из-за ограничения когорты живорождений, используя наиболее экстремальный сценарий.
- Чтобы еще больше снизить вероятность искажения переменных, пациенты, принимавшие другие противорвотные средства, использовались в качестве альтернативных контрольных групп в дополнительных анализах, что привело к сравнению трех общих групп.
- Неизвестные женщины.
- Женщины, подвергшиеся воздействию ондансетрона.
- Женщины, принимавшие другие противорвотные средства.
- Избежать заражения контрольной группы за счет исключения женщин, которые получали рецепт за 3 месяца до начала беременности, поскольку у них все еще могло быть лекарство, доступное для приема внутрь после начала беременности.
- Смотрел в истории болезни матери на предмет врожденных аномалий, потому что заявки на участие в программе Medicaid иногда регистрируются от имени матери до того, как будет обработано право ребенка на участие.
- Рассмотрен очень широкий спектр потенциальных факторов, влияющих на факторы (например, показания к лечению, демографические данные, состояние матери, сопутствующее использование лекарств и т. д.).
- Выполнил подтверждающий анализ 200 эмпирически определенных ковариат в дополнение к заранее заданным ковариатам, чтобы учесть возможные остаточные искажения.
- Неизмеряемые ковариаты могут служить неизвестными искажающими переменными, искажающими данные. Это распространенное и хорошо известное ограничение использования показателя склонности.
- Распространенность при рождении использовалась в качестве показателя абсолютного риска при допущении, что лишь небольшая часть плодов с несиндромальными дефектами умрет или будет прервана внутриутробно. Следовательно, реальный риск может быть немного выше.
- Группы не были хорошо сбалансированы, поскольку женщины в группе, получавшей ондансетрон, имели больше маркеров сопутствующего заболевания и тяжести заболевания в нескорректированном анализе.
- Заполнение рецепта не обязательно означает, что пациент действительно принимал лекарство, особенно если лекарство принималось только один раз.
- Эта когорта беременностей была ограничена живорождением, поэтому серьезные врожденные пороки развития, приведшие к потере или прерыванию беременности, были упущены.
- Кроме того, использование базы данных Medicaid, состоящей в основном из неблагополучных женщин, ограничивает внешнюю валидность этого исследования, поскольку во многих странах, кроме США, существует форма всеобщего здравоохранения.
- Авторы не учли предыдущий опыт пациенток с ондансетроном и то, как это может исказить данные, особенно если ондансетрон принимался до беременности.
- Период времени настоящего исследования с 2000 по 2013 год также может способствовать смещению выборки.
- Возможно, существует значительная предвзятость в пользу использования Ондансетрона, поскольку несколько авторов получили гранты от GlaxoSmithKline, единственного создателя Ондансетрона с середины 1980-х по 2006 год.
- Это исследование значительно расширяет имеющиеся в настоящее время доказательства, которые были ограничены когортой из 1349 подвергшихся воздействию женщин, и предыдущее исследование случай-контроль, которое показало отсутствие риска на основе 11 зараженных случаев.
- Важно помнить, что в этом исследовании изучаются потенциальные долгосрочные эффекты всего ондансетрона, назначенного в течение нескольких дней в течение первого триместра. Эти эффекты могут быть неприменимы к однократной (или двукратной) дозе, введенной в отделении неотложной помощи.
- Когда авторы использовали женщин, которые подвергались воздействию других противорвотных средств, в качестве контрольной группы и сравнили их с основным анализом ондансетрона, значительных различий не было. Кроме того, результаты были одинаковыми для отдельных противорвотных средств.
- Авторы пересмотрели определение воздействия, выполнив 2 или более рецептов на ондансетрон, чтобы оценить потенциальный эффект несоответствующего воздействия и охватить пациентов, которые выполнили И выполнили прием своего первого рецепта.
- Их новое определение окна воздействия на 6–12 недель было оправдано, поскольку это был период наибольшей чувствительности к тератогенам при расщелинах рта. Результаты не были чувствительны к изменениям ни в экспозиции, ни в переопределении окна экспозиции.
- Оценка склонности помогает ограничить искажающие переменные, однако для того, чтобы авторы пришли к своему заключению, было выполнено значительное количество статистических манипуляций, о чем свидетельствуют многочисленные анализы и несколько уровней оценки.
- Есть компонент личного предубеждения, который авторы упустили. Пациентка, которая ранее принимала ондансетрон во время беременности с успешным купированием симптомов и отсутствием вреда для новорожденного, может быть более склонна принять его снова, игнорируя предполагаемые риски врожденных пороков развития. Авторы не упомянули об исключении этих пациентов или даже о наличии в базе данных такой информации.
- Авторы оправдывают использование периода с 2000 по 2013 год как самые свежие данные, доступные на момент проведения исследования, однако неясно, почему они относятся только к 2000 году, когда Ондансетрон существует с середины прошлого века. 1980-е гг.
- Нельзя упускать из виду использование преимущественно неблагополучной когорты (например, базы данных Medicaid). Если бы эта база данных поступила из другой страны, отличной от США, где существует более унифицированная система здравоохранения с более легким доступом к базам данных и записям, результаты, вероятно, могут быть совсем другими.
- И наконец, важный момент, который, по-видимому, не рассматривается авторами, — это общая клиническая картина отдельного пациента. Хотя риск расщелины ротовой полости невелик, важно всегда учитывать как краткосрочные, так и долгосрочные преимущества и потенциальный вред любого вмешательства, а также то, как они применимы к каждому отдельному пациенту.
Выводы автора:
«Среди новорожденных от матерей, участвующих в программе Medicaid, воздействие ондансетрона в первом триместре не было связано с сердечными или врожденными пороками развития в целом после учета измеренных факторов, но было связано с небольшим повышенным риском возникновения расщелин полости рта».
Наш вывод:
Учитывая, что с этической точки зрения было невозможно провести рандомизированное контролируемое исследование влияния ондансетрона на врожденные пороки развития, это исследование предоставляет нам дополнительную полезную информацию о потенциальных рисках врожденных пороков развития при применении ондансетрона во время беременности. В этом исследовании есть много предубеждений и ограничений, которые могут ограничить его результаты, однако, поскольку это одна из крупнейших баз данных, доступных в настоящее время, она поддерживает безопасность и использование Ондансетрона для прекращения тошноты и рвоты в первом триместре беременности.